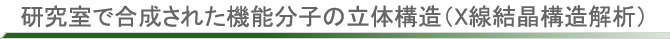 |
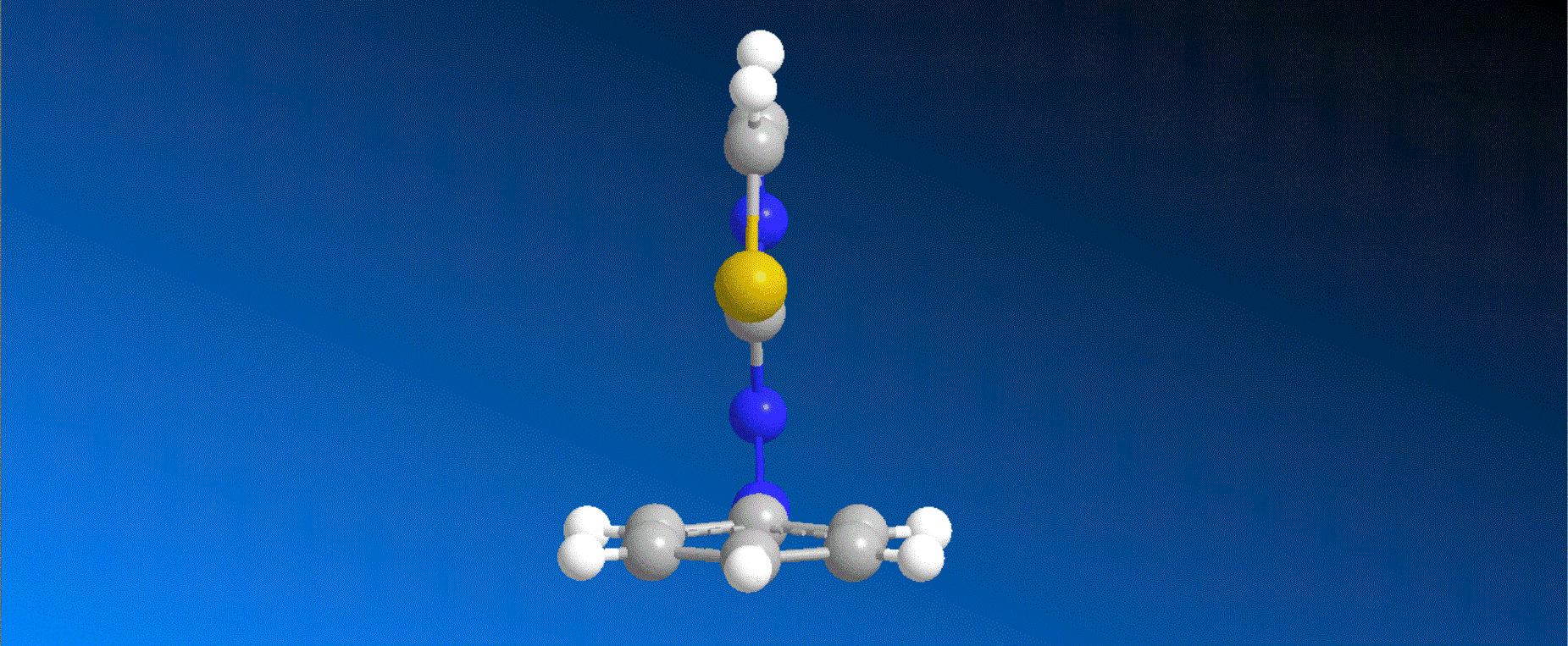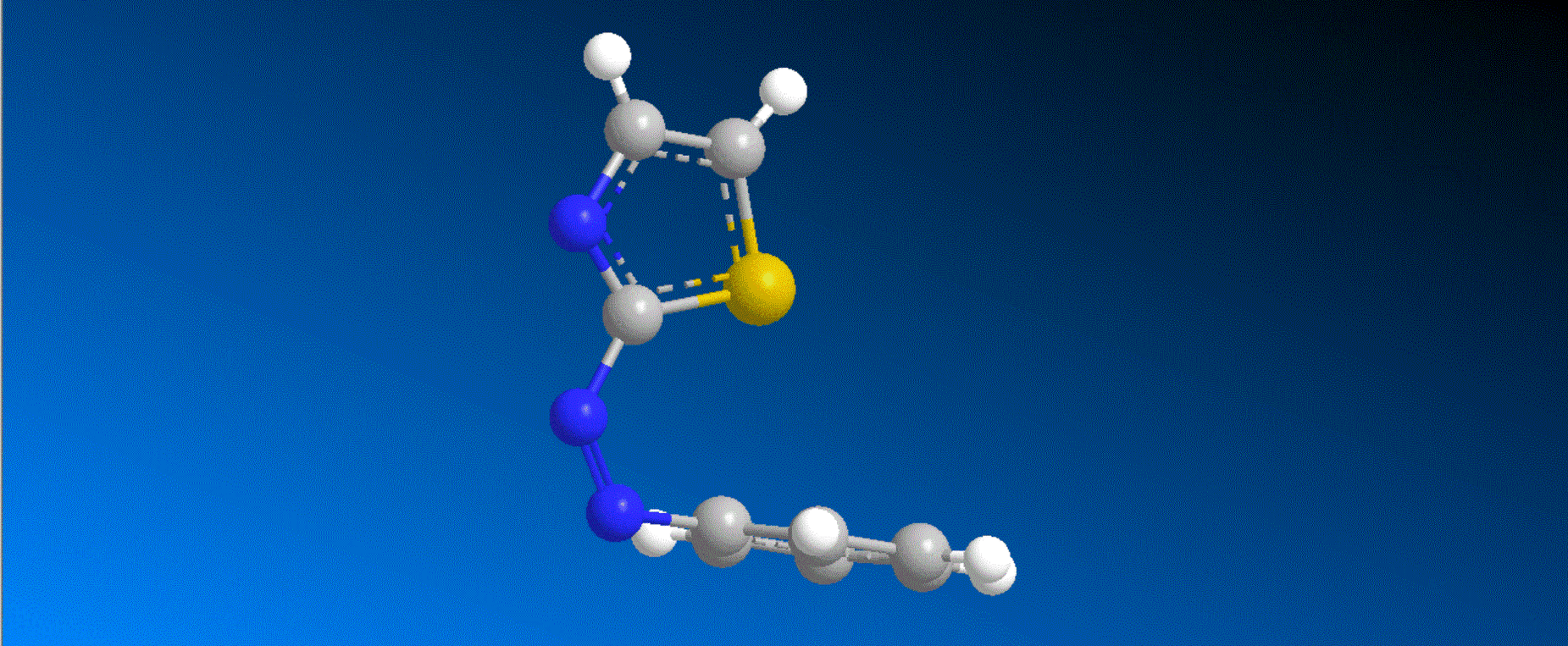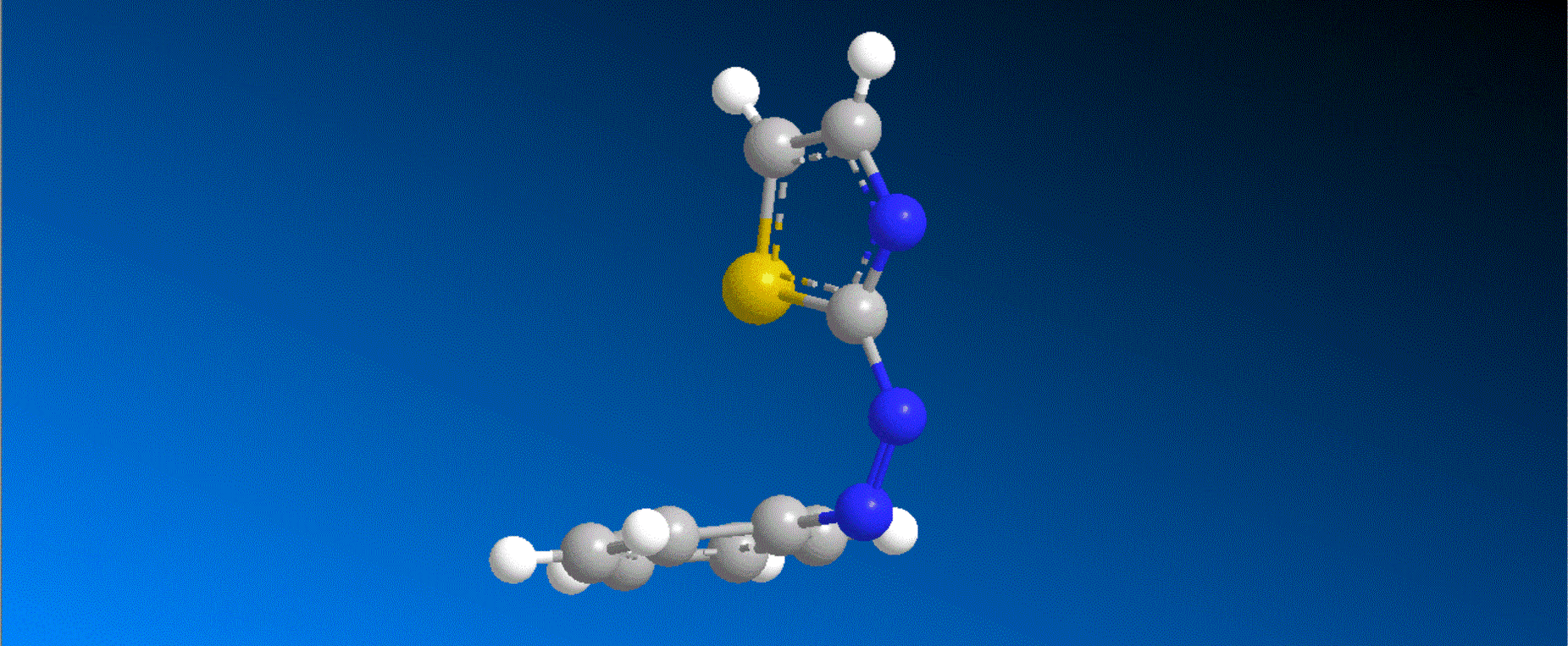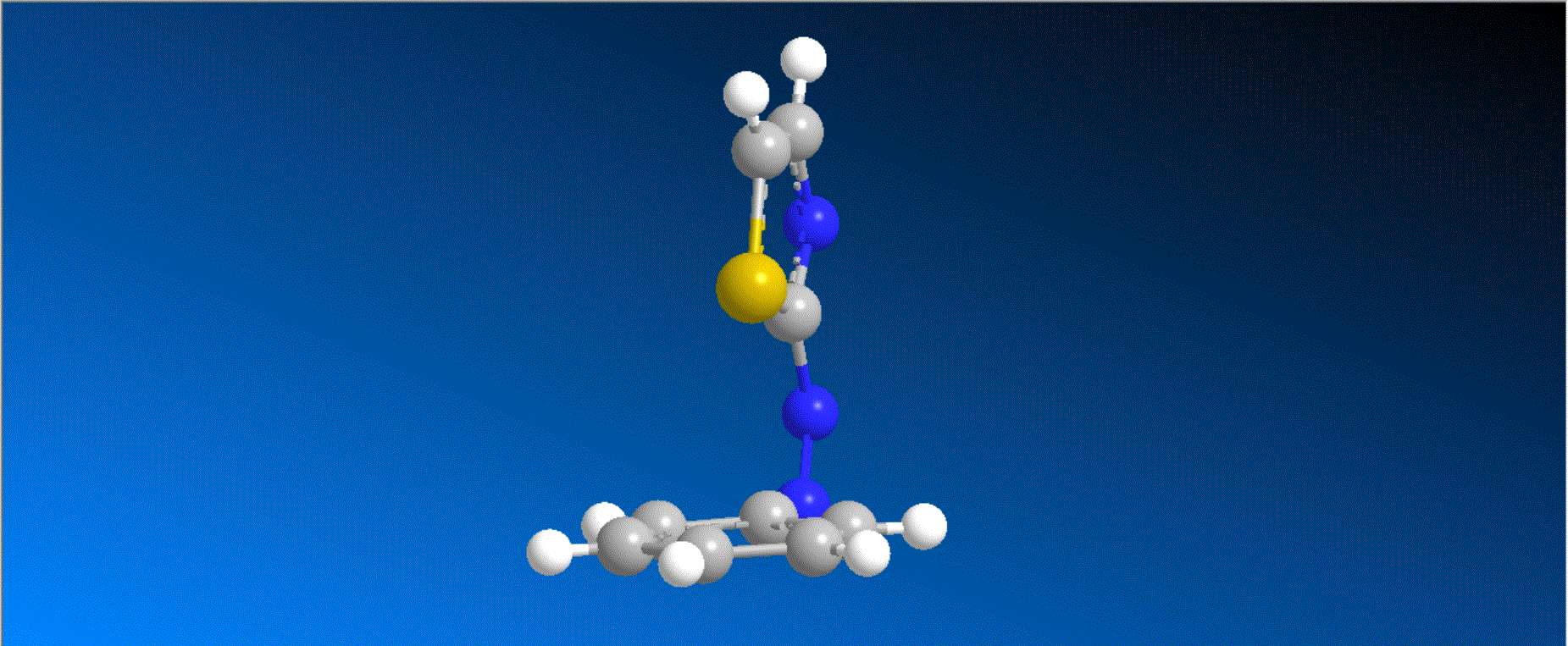
アゾベンゼンは、光によってトランス体とシス体の2状態間で変換可能な光分子スイッチとして盛んに研究されています。トランス体では2つのフェニル基とアゾ基が1つの平面上に存在する平面構造が最も安定な配座であるのに対して、シス体では、2つのフェニル基のオルト位の水素の反発のために完全な平面構造を取れず、2つのフェニル基の一部が重なり合った平行に近い配座を取ることが知られています。一方で、アゾベンゼンの1つのフェニル基をヘテロ環で置換したヘテロアリールアゾベンゼンの一部のシス体では、フェニル基とヘテロアリール基が完全に直交した配座を安定に取りうるのではないかと予想されていましたが、実際に直交した構造を確かめた研究はありませんでした。今回、我々はフェニルアゾチアゾールのシス体を単離、結晶化し、X線結晶構造解析で構造を確認したところ、フェニル基とチアゾール基が完全に直交した構造を取っていることを明らかにしました。硫黄原子のn軌道からフェニル基のπ*軌道への電荷移動が本構造の安定性の根源であることも量子化学計算によって確認しました。今後、このような2つのアリール基が直交する分子構造を取ることを利用した新しい光分子スイッチの開拓が期待されます。
詳しくは、Runze Lin, P. K. Hashim, Saugata Sahu, Ammathnadu S. Amrutha, Nusaiba Madappuram Cheruthu, Shakkeeb Thazhathethil, Kiyonori Takahashi, Takayoshi Nakamura, Takashi Kikukawa, and Nobuyuki Tamaoki, "Phenylazothiazoles as Visible-Light Photoswitches",J. Am. Chem. Soc., 2023, 145, 16, 9072-9080
|
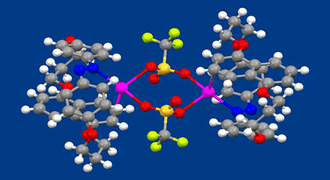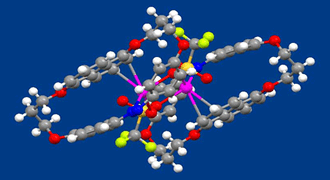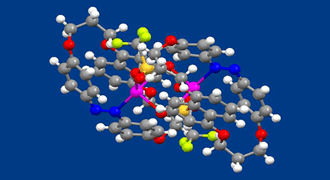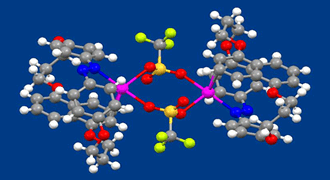
アゾベンゼンは光を吸収してトランス−シス異性化反応を示し,形状だけでなく分子の極性も大きく変わることから,分子機械のエンジン部位や様々な機能性分子システムの制御部として用いられてきました。一方で、アゾベンゼンの窒素は、孤立電子対を有しているため、それを配位子として利用した金属錯体が形成される可能性はあるものの、アゾベンゼンを配位子とする金属錯体を合成した研究やその金属錯体のX線結晶構造解析を行った研究の例はあまり多くありません。我々は,ナフタレンを含む環状アゾベンゼンが、銀イオンに対してアゾベンゼンの孤立電子対とナフタレンのπ電子の二箇所で配位して安定な金属錯体を形成し、その構造をX線結晶構造解析やNMRで確認することに成功しました。この化合物について興味深い特性は、ナフタレンと銀イオンの相互作用が,配位子のトランス体からシス体への光異性化反応によって失われることです。これは、NMRスペクトルの解析によって確認されました。シス体における銀イオン(アゾベンゼンの窒素の近くにある)とナフタレンとの距離が長いことによるとして説明できます。このような銀イオンとパイ電子系との相互作用を光でON-OFFできる特性を活用すれば、より高度な運動を示す分子機械の構築が可能になると考えています。
詳しくは
Yoshimi Oka, Nobuyuki Tamaoki
"Structurof Silver(I)Complex Prepared from Azobenzenonaphthalenophane, Photochemical Coordination Change of Silver(I) and Silver(I)-Induced Acceleration of Z-E Thermal Isomerization of Azobenzene Unit",
Inorg.Chem., 2010,49,4765-4767.
|
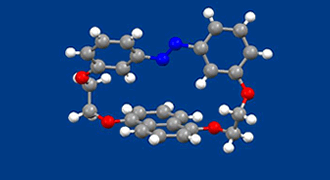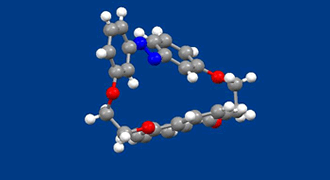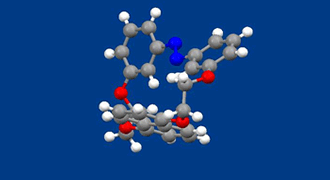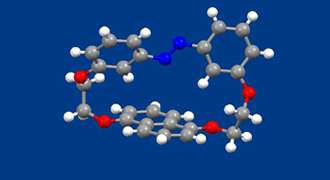
ブレーキは、マクロな世界での自動車においてアクセルと同様に重要な機械であるのと同様に分子の世界でも重要です。これまで分子内の回転運動を光で可逆的に制御することを目指した研究はいくつかありましたが、いずれも回転を止めたり動かしたりを完全に制御することはできず、最もうまく止めた場合でも3回転/秒の回転運動を許していました。今回、完全に回転が止まった状態を「ラセミ化反応が起こらないこと」で証明する方法を新たに提案し、実際に新規にデザインした化合物を合成して、回転が起こる状態と完全に止まった状態を光でスイッチできることを示しました。
合成した化合物は光によって構造を可逆的に大きく変えるアゾベンゼン部とローターとして働くナフタレン部を環状に結合した構造を有しています。ナフタレンの結合位置は1,5位であり、ナフタレンの分子内回転が起こらない場合、面性不斉によって、一対の鏡像異性体が存在することになります。合成後に得られる化合物のアゾベンゼン部は伸びきったトランス構造を有し、一対の鏡像異性体をキラルカラムによって光学分割できることがわかりました。一方、紫外線照射によって得られるシス−アゾベンゼンの異性体では、ナフタレンローターが回転することが、キラルカラムを用いたHPLCや円二色性分光法で確認できました。シス−アゾベンゼンは可視光照射によってもとのトランス体に戻るので、光のみでナフタレンローターの回転を繰り返し、完全にON-OFF出来ることになります。
今後、分子自動車の部品として組み込んだり、機械的ねじりや円偏光等の物理的な不斉場を認識するキラル場センサーとして利用することが期待できます。
詳しくは
Meethale C. Basheer, Yoshimi Oka, Manoj Mathews, Nobuyuki Tamaoki
"A Light-Controlled Molecular Brake with Complete ON-OFF Rotation",
Chem.-Eur.J., 2010,16,3489-3496.
|
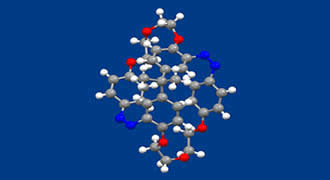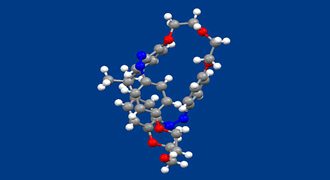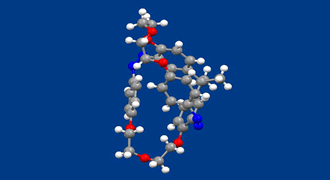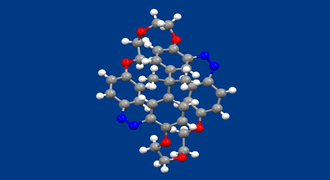
液晶は、ナノサイズの分子が分子間相互作用を介してマクロサイズの集合体を形成し、光学機能をはじめとする様々な機能を発現しており、ナノとマクロをつなぐことを特徴とする材料の代表的な例と言えます。分子の形態が棒状と球状の間でスイッチされれば、分子集合状態も一軸に揃った配列(ネマティック)と等方相の間でスイッチできます。同様に、分子の右手、左手(キラリティー)をスイッチすれば、分子配列の右巻き、左巻きがスイッチでき、結果として左右円偏光に対する屈折率や反射率を制御する新たな偏光制御材料が可能です。今日の3D表示等からの要請で円偏光を制御する技術に対する期待は高まっていますが、これまで分子配列の巻き方向を高速でスイッチすることは困難でした。この実現のためには、光などの高速スイッチ可能な刺激で、右型、左型がスイッチできる新分子の開発が必要です。
われわれは、面不斉を利用する新規光応答性キラル化合物を合成し、その中の一つである本化合物(X線結晶構造の図はトランス-トランス体から光反応によって得たシス-シス体)が、光反応によって液晶に対するねじりの向きを逆転させることを見出しました。化合物には、安定な鏡像異性体が存在し、キラルカラムを使って分割することが可能です。各鏡像異性体には、2箇所のアゾベンゼン部位のトランス−シス異性体が存在します。一方の鏡像異性体(トランス−トランス体)をネマティック液晶に添加すると、液晶の分子配列をねじる能力があることがわかりました。そこで紫外線を照射して添加剤のアゾベンゼン部位をトランスからシスへ異性化させると、液晶をねじる向きが逆転することがわかりました。現在のところ、シス体からトランス体への可視光を使った逆異性化反応の効率が良くないため、光のみでねじりの向きを繰り返し逆転することは出来ていません。今後は、面不斉を使った新しい光応答性キラル添加剤を合成し、光のみで高速に液晶のねじりを繰り返し反転できるようにしたいと考えています。
詳しくは
Manoj Mathews, Nobuyuki Tamaoki,
"Reversibly tunable helicity induction and inversion in liquid crystal self-assembly by a planar chiroptic trigger molecule",
Chem.Commun, 2009, 3609-3611.
|
|
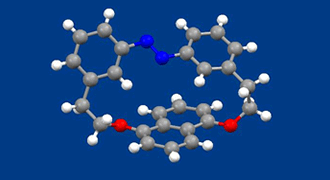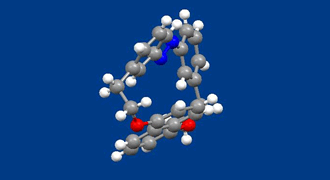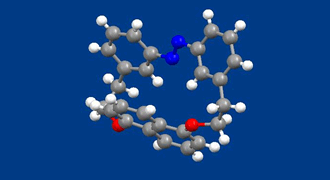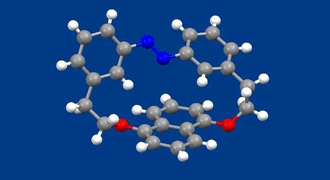
本化合物は、光異性反応を示すアゾベンゼンとナフタレンを環状に結合したものです。1,5位で結合したナフタレンはアゾベンゼン部位が障害となり、1,5位を結ぶ軸を中心にした回転運動(アゾベンゼンから見るとナフタレンの周囲を回る縄跳び運動)ができません。その結果、2つの鏡像異性体が存在することになります(回転している絵は、R体、S体のうちのS体です)。光学中心を持たないのに不斉になるのは面不斉という不斉要素を持つためです。
我々は、光学分割した鏡像異性体の不斉の特徴と、光異性化反応を起こして分子の性質が変わることを生かして、液晶分子配列のねじれを光で可逆的に制御することに成功しました。その結果、本化合物を添加した液晶の色(構造色)を光で自由に変化させることができます。
詳しくは Manoj Mathews, Nobuyuki Tamaoki,
"Planar Chiral Azobenzenophanes as Chiroptic Switches for Photon Mode Reversible Reflection Color Control in Induced Chiral Nematic Liquid Crystals",
J. Am. Chem. Soc., 2008, 130, 11409-11416.
|
|
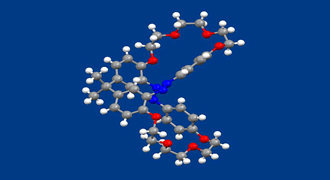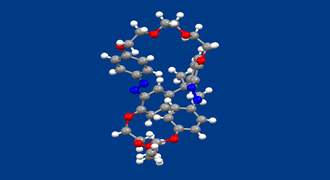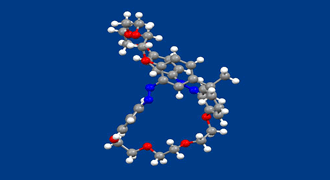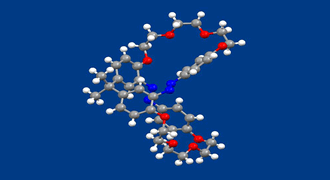
タンパク質、糖、DNAに代表される自然界の生体関連化合物は一方の鏡像異性体から成っています(ホモキラリティー)。なぜ、一方の鏡像異性体のみになったのか、なぜ、アミノ酸であればd体ではなくl体なのか、その起源は、はっきりしません。一つの可能な説は、まず、何らかの物理的な作用で、一方の鏡像異性体がわずかに多く存在するようになり、その後の化学的な作用でその傾向が増幅されたとするものです。しかし、物理的な作用で一方の鏡像異性体が多くなる、すなわち、例えばR←←→Sのような現象の例は多くありません。
われわれは、鏡像異性体を区別する、円偏光による新しい光反応の系を実現すべく、本化合物を設計、合成しました。化合物は、2つのアゾベンゼン部を含むビシクロ構造をとっています。不斉中心は存在しませんが、面不斉という不斉要素を有するため、鏡像異性体が存在します。光反応性の2つのアゾベンゼン部がトランス体である時鏡像異性体はお互いに安定ですが、光照射で生成するシス体では、鏡像異性体間で容易にラセミ化を起こすことがわかりました。左または右円偏光を照射すると、一方の鏡像異性体(トランス体)をより多くすることができました。続けて、もう一方の円偏光照射では、もう一方の鏡像異性体がより多くなりました。
このような円偏光による一方の鏡像異性体の過剰化が、ホモキラリティーの起源となっているのかも知れません。
詳しくは Nobuyuki Tamaoki and Momoyo Wada,
"Dynamic Control of Racemization Rate through E-Z Photoisomerzation of Azobenzene and Subsequent Partial Photoresolution under Circular Polarized Light",
J.Am. Chem. Soc., 2006, 128, 6284-6285.
|
|
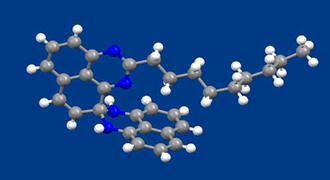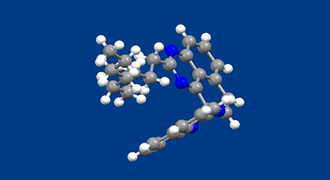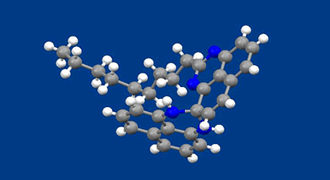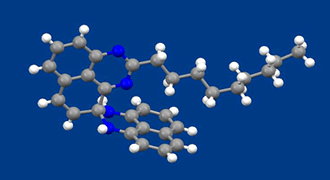
古くから知られた光機能性分子の1つとしてフォトクロミック分子があります。光の作用によって分子構造が可逆的に変化し、それに伴って色が可逆的に変化するものです。入ってくる光の量や紫外線量に応じて、色を自動的に調節する調光材料(サングラスや窓ガラス)として、または、光で記録を書き込んだり、読み出したりする光メモリーとして応用するために多くの分子が合成されてきました。調光材料として応用するためには、発色状態で可視域の広い領域で吸収を持つことが要求されます。
上で示した分子は、1,8-ジアミノナフタレンを酸化して得られるスピロ型二量体をベースに合成されたものです。この状態では2つのジアミノナフタレン部は直交し、スピロ炭素を介して結合しているために、π共役系は切れていて、薄い黄色しか示しません。紫外線を照射するとC-N結合が切れ、分子全体が平面の共役構造となるため、直ちに深緑色に変化します。吸収スペクトルを測定すると400nm−800nmの可視全域で光を吸収していることがわかります。この状態は、暗所に置いておくと元の淡黄色の状態に戻ります。
本分子はさらに、けい光性という興味深い特性を示しました。紫外線を照射する前は、全くけい光を示しませんが、紫外線を照射した後の深緑の状態は強くけい光を発しました。すなわち、けい光を発する、発しないという2つの状態を光反応でスイッチできる新しいタイプのフォトクロミック分子であることがわかりました。
このような特性は、けい光で高感度に記録を読み出すことが可能な光メモリーや光応答性の標識物質等への応用が期待できます。
詳しくは Riju Davis and Nobuyuki Tamaoki,
"Modulation of Unconventional Fluorescence of Novel Photochromic Perimidine Spirodimers",Chem. Eur. J., 2007, 13, 626-631.
|
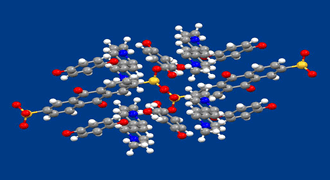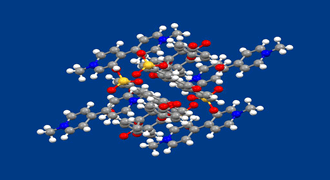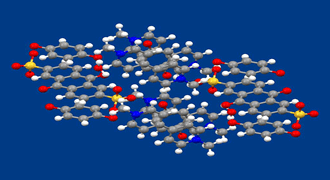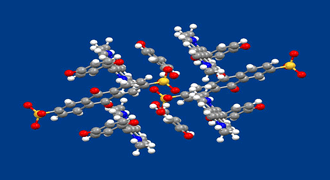
分子の自発的な組織化による機能材料の構築は、省エネルギーで精度の高い分子配列を有する材料を実現できる方法として期待が高まっています。分子が組織化する駆動力としてはファン・デル・ワールス力や水素結合などのあらゆる分子間力が利用できますが、近年、電荷移動相互作用が結合の方向を予測できる力として注目されています。また、電荷移動相互作用は電荷移動吸収を生じるなど光・電子特性の点からも興味が持たれます。
我々は、電荷移動相互作用と静電的相互作用を組み合わせることで、より複雑ではあるが高度な分子組織体が構築できるのではないかと考え、電子アクセプターイオンペアと電子ドナーとの複合結晶の合成を検討しました。その結果、二種の電荷移動錯体のカラムが直交して存在する有機結晶など興味深い物質群を構築することに成功しました。
図は得られた有機結晶の構造を示します。電子アクセプターとなりうる1,5-アントラキノンジスルホン酸(1)とジメチルビオロゲン(2)および電子ドナーとして働くヒドロキノン(3)を含んでいます。1のアルカリ金属塩、2の塩化物と3を水中で混合するだけで得られます。析出してくる結晶には、アルカリ金属イオンや塩素イオンは含まれていません。図中、上下の方向にジメチルビオロゲンとヒドロキノンの、それと直交する方向にアントラキノンスルホン酸とヒドロキノンの交互型電荷移動錯体のカラムが存在しています。これらのカラムはそれぞれ456と462nmに極大を有する、異なる二つの電荷移動吸収を示すことが偏光吸収スペクトルの測定から明らかとなりました。
このように電荷移動および静電的な相互作用を同時に利用することで三種の芳香族ユニットを一つの結晶中に存在せしめ、また、スルホン酸基の位置を変化させることで様々な電荷移動錯体の形態が生まれました。得られる有機結晶の分子配列を完全に予測することは現在のところ困難であるが機能材料創成の新しい方法になると考えます。
詳しくは Masatoshi Kidowaki and Nobuyuki Tamaoki,
"Unique crystal structure of donor acceptor complex: crossed arrangement of two charge-transfer columns",
Chem. Commun., 2003, 290-291.
|
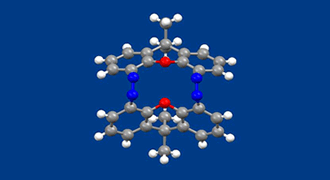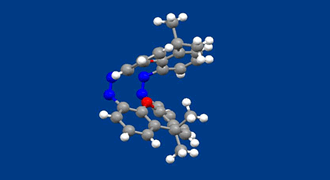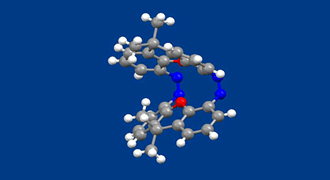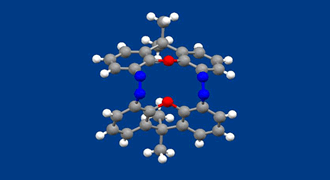
われわれは、機械のように別の形で与えられるエネルギーを運動エネルギーに変換する分子、すなわち分子機械を合成しようとしています。
機械は、一定の許容された運動のみを起こすことで仕事をすることができます。したがって分子機械構築の第一歩は、与えられたエネルギーによって、より制御された運動を示す分子を合成することです。
アゾベンゼンは、トランス⇔シス光異性化反応という伸びきり状態と折れ曲がり状態の間で構造変化を起こすことから、分子蝶番であると言うことができます。しかし、アゾベンゼンはマクロな世界の蝶番とは違いねじれの構造変化を起こしてしまい、厳密には蝶番とは異なります。
われわれは、ねじれの構造変化を許さない、より実際の蝶番に近い運動を示す分子を目指しました。
本化合物ではアゾベンゼン2つを剛直なキサンテン構造で環状に結びつけています。そのため、2つのアゾベンゼンはねじれが起こらず、紫外線を当てると2つは協調して同じ向きに折れ曲がります(結晶構造はこの折れ曲がった状態の構造です)。可視光を照射するとまた元の伸びきった構造にもどります。ねじれ運動がないために、より現実的に何かの仕事をさせるために活用できると考えられます。
詳細は S. Anitha Nagamani, Yasuo Norikane, and Nobuyuki Tamaoki,
"Photoinduced Hinge Like Molecular Motion: Studies on Xanthene Based Cyclic Azobenzene Dimers",
J. Org. Chem., 2005, 70, 9304-9313.
| |
|
|